| |
| Med Sci (Paris). 2008 February; 24(2): 191–196. Published online 2008 February 15. doi: 10.1051/medsci/2008242191.Manipulation du système immunitaire par le parasite Toxoplasma gondii
Dominique Buzoni-Gatel,1* Jean-François Dubremetz,2* and Catherine Werts1* 1RPPI, Institut Pasteur-Inra, 28, rue du Docteur Roux, 75724 Paris, France 2UMR CNRS 5539 Bâtiment 24, CC 10, Université de Montpellier, 2, place Eugène Bataillon, 34095 Montpellier Cedex 05, France |
Le parasite : Toxoplasma gondii
Toxoplasma gondii est un parasite intracellulaire obligatoire qui infecte un large spectre d’hôtes à sang chaud. L’infection peut être transmise de l’animal à l’homme de deux façons. La première est due à l’excrétion d’oocystes dans les fèces du chat, qui souillent des légumes ou des fourrages. Le chat, ou plus généralement les félidés, sont les seuls animaux qui excrètent le toxoplasme, et sont les seuls à permettre leur reproduction sexuée dont sont issus les oocystes. Après sporulation, qui intervient dans le milieu extérieur dans un délai de un à 21 jours en fonction des conditions hygrométriques, de température et d’aération du milieu, les oocystes renferment deux sporocystes contenant chacun 4 sporozoïtes. Les sporozoïtes sont infectieux et contaminent l’homme et les animaux après leur ingestion. Les sporozoïtes ingérés par l’homme ou par des herbivores comme les moutons, se transforment en tachyzoïtes, formes réplicatives du parasite. Les tachyzoïtes se multiplient par division binaire dans les cellules de l’hôte au sein d’une vacuole. Après plusieurs divisions, et par un processus complexe, les tachyzoïtes sortent de la vacuole, font éclater la cellule qui les héberge et infectent les cellules adjacentes. Puis, après quelques cycles de division, sous la pression du système immunitaire, les tachyzoïtes donnent naissance à des bradyzoïtes contenus dans des kystes intracellulaires. Les lieux privilégiés de l’enkystement sont les cellules musculaires et cérébrales. La deuxième source de contamination humaine par le toxoplasme est la viande contenant des kystes. Les herbivores comme le mouton sont souvent porteurs de kystes puisqu’ils broutent de l’herbe parfois contaminée par les oocystes présents dans les fèces du chat. L’homme se contamine alors en mangeant de la viande de mouton peu cuite, la chaleur ne suffisant pas dans ce cas à détruire les kystes. Chez l’homme ou l’animal, l’infection par Toxoplasma gondii passe inaperçue dans la majorité des cas, mais provoque des avortements ou des lésions irréversibles du foetus lorsqu’elle est acquise in utero chez les individus non immunisés. En effet, il existe une forte immunité de prémunition, certainement due au fait que l’hôte infecté ne se débarrasse jamais des kystes. Cette infection latente peut perdurer sans dommage tout au long de la vie. Mais, à la faveur d’une immunosuppression, comme elle existe chez les malades atteints du SIDA ou chez les greffés, la réactivation des kystes, qui fait passer le toxoplasme de l’état de bradyzoïte dormant à l’état de tachyzoïte (Figure 1), conduit à des lésions graves comme des encéphalites, mortelles en l’absence de traitement médicamenteux. Seul existe un vaccin adapté aux petits ruminants (chèvres, moutons) qui, avec le chat, sont des éléments clés du cycle de ce parasite. Ce vaccin vivant atténué présente des risques de réversion et n’est donc pas adapté à l’homme. La prophylaxie consiste en une immunosurveillance des femmes enceintes et en une thérapie antibiotique plus ou moins efficace en cas de séroconversion.
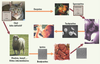 | Figure 1.
Cycle de Toxoplasma gondii. Le chat, ou de façon plus générale les félidés, sont les seuls animaux dans lesquels le parasite effectue une reproduction sexuée, assurant un brassage chromosomique entre les souches. Dans les autres hôtes, le parasite se divise par scissiparité. Le chat est aussi l’unique hôte capable d’excréter le toxoplasme sous la forme d’oocystes dans ses fèces. Les oocystes ainsi excrétés souillent les légumes ou encore les pâturages. Les herbivores, tel le mouton, broutent l’herbe et peuvent ainsi se contaminer. Chez les herbivores, le parasite s’enkyste sous forme de bradyzoïtes dans le cerveau mais aussi dans la viande. L’homme s’infecte en mangeant de la viande peu cuite parasitée par des kystes ou des légumes mal lavés contenant des oocystes. L’infection est particulièrement grave pour le fœtus lorsque la mère s’infecte pour la première fois durant la grossesse. Le parasite se multiplie dans l’hôte sous forme de tachyzoïtes (d’après Ermmano Candolfi). |
|
Subversion de l’immunité par le parasite Le toxoplasme établit avec le système immunitaire de l’hôte un dialogue subtil [
1] (Figure 2). Dès sa pénétration sous forme de tachyzoïte, il déclenche une réponse du système immunitaire inné. En effet, les entérocytes répondent à la pénétration du parasite en sécrétant des cytokines et des chimiokines qui attirent au lieu de l’infection les monocytes et les cellules dendritiques. Ces entérocytes ainsi parasités seront les catalyseurs d’une réponse adaptative débutée dans la lamina propria et les ganglions mésentériques. La sécrétion de monoxyde d’azote (NO), d’interleukine-12 (IL-12), d’interféron-γ (IFN-γ), de tumor necrosis factor-α (TNF-α) engendrée par l’activation de la réponse immune conduit, directement ou indirectement, à l’inhibition de la réplication du parasite et à son élimination partielle. Si cette réponse immune de type Th1 est insuffisamment régulée, en particulier par la production insuffisante de TGF-β par certaines sous-populations de lymphocytes intra-épithéliaux, des phénomènes immunopathologiques peuvent alors se développer. Ainsi, les souris C57BL/6 meurent d’une iléite nécrosante dans les dix jours qui suivent l’ingestion de kystes de toxoplasme. Si la réponse immune intestinale vise à limiter l’intrusion du parasite, ce dernier va aussi se servir de l’activation du système immunitaire pour établir son cycle infectieux. En effet, les parasites colonisent les monocytes et les cellules dendritiques présents dans les plaques de Peyer et la lamina propria. Ces cellules ainsi parasitées sont drainées dans les ganglions mésentériques puis s’échappent dans la circulation sanguine, colonisent la rate, le poumon le foie avant de s’infiltrer dans le cerveau [
2]. Sous la pression du système immunitaire, en particulier de l’IFN-γ, les tachyzoïtes intracellulaires se transforment en bradyzoïtes, dans des kystes [
3]. Les cytokines produites par le système immunitaire dont l’IFN-γ activent les macrophages ainsi que les cellules dendritiques, limitant ainsi la prolifération intempestive des parasites et empêchant également la lyse de ces cellules. Les cytokines maintiennent donc l’hôte en vie, disponible pour le parasite intracellulaire obligatoire et participent à la pérennisation de l’infection. Les monocytes transportent le parasite dans les muscles et le cerveau, deux lieux d’enkystement. C’est donc en manipulant le système immunitaire que le toxoplasme accomplit son cycle infectieux.
 | Figure 2.
La réponse immune intestinale. Le parasite, pénétrant dans les entérocytes, induit la sécrétion de NO (monoxyde d’azote), d’IL-15 et de chimiokines. Le NO limite la réplication du parasite. Ceux qui échappent à ce contrôle seront pris en charge par les polynucléaires (PMN), les macrophages (MΦ), les cellules dendritiques (DC), attirés au lieu de l’infection par les chimiokines. Quelles qu’elles soient, les cellules parasitées produisent diverses cytokines. Parmi elles, l’IL-15 est un puissant activateur des cellules NKT, cellules productrices d’IFN-γ et qui activeront via une réaction en chaîne les lymphocytes T de la lamina propria. Les MΦ, les DC et les PMN sont des pourvoyeurs d’IL-12, cytokine activatrice des cellules T CD4 effectrices de la lamina propria, qui, après stimulation, produisent l’IFN-γ. L’IFN−γ est une molécule microbiostatique, qui favorise aussi l’enkystement du parasite mais qui est un puissant agent inflammatoire. En l’absence de régulation, l’inflammation tuera l’animal. Les cellules B catalysent la production d’IFN-γ par les lymphocytes T. Certaines sous-populations de lymphocytes intra-épitheliaux (LIE, TCR α/β) en produisant du TGF-β tendent à limiter la réaction inflammatoire intempestive déclenchée par l’intrusion du parasite. Une autre sous-population de LIE en revanche est activée par l’IL-15 et tuera par cytotoxicité les entérocytes infectés, limitant l’invasion parasitaire mais causant des dommages épithéliaux (d’après [ 1]). |
|
Interactions moléculaires entre le parasite et le système immunitaire Polymorphisme de Toxoplasma gondii et activation de STAT3 et STAT6 La plupart des souches de toxoplasme isolées en Europe ou en Amérique du Nord ont été classées en 3 lignées clonales (type I, II et III), correspondant à des génotypes différents, qui ont été intégralement cartographiés et séquencés. Ces souches diffèrent par de multiples critères phénotypiques comme leur virulence, leur persistance, leur capacité migratoire, leur faculté à attirer des cellules et à induire la sécrétion de cytokines. La plupart de ces observations ont été réalisées chez la souris, mais de telles différences existent aussi dans les infections humaines. Afin de montrer que ces différences sont liées à la manière dont ces souches interagissent avec la cellule hôte, l’équipe de John Boothroyd [
4] a infecté des cellules fibroblastiques humaines puis comparé par une analyse transcriptomique les gènes de la cellule hôte dont l’expression est modifiée en réponse à une infection par ces trois types de souches. Après cartographie des gènes impliqués, des croisements entre des souches de type II et III ont été réalisés chez le chat et une nouvelle analyse transcriptomique a été effectuée sur une série de clones issus des croisements. Les clones issus des croisements ont été cartographiés génomiquement, puis utilisés pour infecter des cellules macrophagiques humaines. Ces études ont permis d’associer un polymorphisme de certains gènes de toxoplasme à une différence d’expression de gènes humains. En particulier, il apparaît qu’une activation spécifique des voies de signalisation de STAT3/6 par les produits de certains gènes du toxoplasme est corrélée à l’expression des différences phénotypiques entre les trois types de souches. L’infection avec les souches de type I et III est associée à une activation, traduite par une phosphorylation plus importante de STAT3 et STAT6 chez l’hôte qu’après une infection avec les souches de type II. L’IL-10 est une cytokine connue pour ses activités immunorégulatrices, et qui agit en particulier via la phosphorylation de STAT3. STAT6 a aussi un effet immunorégulateur puisqu’il est impliqué dans la limitation de la production de NO. En effet l’activation de STAT6 conduit à la production d’arginase qui utilise l’arginine, substrat de la formation de NO. Or le NO a un effet microbicide sur le toxoplasme. La compétition pour l’utilisation de l’arginine affaiblit par conséquent la production de NO [
5]. Polymorphisme de la protéine ROP16 et sécrétion d’IL-12 La cartographie des gènes des souches de toxoplasme mutées dans la région du chromosome VIIb et l’analyse de leur capacité à activer STAT3/STAT 6 ont facilité l’identification de la protéine ROP16 comme candidat potentiel au support du polymorphisme entre les souches. Cette protéine partage de nombreuses homologies avec des sérine thréonine protéine kinases qui sont des modulateurs de fonctions cellulaires variées. Cette protéine ROP16 est localisée dans les rhoptries, organites apicaux du parasite dont la morphologie rappelle celle des clubs de golf. Les tachyzoïtes possèdent entre 8 à 12 rhoptries qui déversent leur contenu lors de l’invasion parasitaire (Figure 3). Une trentaine de protéines différentes composent ces rhoptries. Lors de l’invasion cellulaire, ces protéines participent à la création de la jonction mobile qui propulse le parasite à l’intérieur de la cellule hôte, tout en formant la vacuole parasitophore au sein de laquelle le parasite va se développer. Sans que le processus ne soit clairement élucidé, certaines de ces protéines de rhoptries, en particulier les protéines solubles comme ROP16, peuvent se retrouver dans le cytoplasme de la cellule hôte puis dans son noyau où elles peuvent interagir avec la signalisation [
6]. Le polymorphisme de la protéine ROP16 injectée dans la cellule hôte semble être lié, au cours du temps, à la différence de capacité des souches à phosphoryler et donc à activer les voies de signalisation STAT3/6. À la différence des souches de type II, les souches de type I et III phosphorylent durablement STAT3. Pour poursuivre la caractérisation de la protéine ROP16, des mutants transgéniques exprimant la protéine ROP16 de type I ou de type II ont été construits. Pour cela, le gène de la protéine ROP16 soit de type I ou II a été introduit dans une souche de type II et son extrémité carboxy-terminale a été marquée avec l’hémagglutinine pour faciliter la sélection des transfectants. La construction de mutants de type II exprimant la protéine ROP16 de type I a permis de relier le polymorphisme de ROP16 ainsi que la phosphorylation de STAT3 à la production d’IL-12. L’infection des macrophages avec des souches de type II induit la sécrétion de quantités d’IL-12 plus importantes que ne le fait l’infection avec des souches de type I et III. Ce phénotype est réversible par l’introduction d’une protéine ROP16 de type I dans les souches de type II. En fait, cette différence de production de cytokines lors de l’infection par des souches de type I et III d’une part, et de type II d’autre part, pourrait être due à la phosphorylation de STAT3 qui constitue un régulateur positif des protéines SOCS ( suppressor of cytokine signaling), naturellement impliquées dans la régulation négative des cytokines (Figure 4). Ainsi, l’équipe de John Boothroyd [ 4] décrit que la nature de la protéine ROP16 peut avoir un rôle dans la régulation de la production d’IL-12 et ainsi avoir un impact majeur sur l’issue de l’infection compte tenu de l’importance de l’IL-12 dans l’activation des cellules immunes.
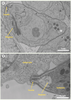 | Figure 3.
Réplication du parasite. L’entrée du tachyzoïte, forme réplicative du parasite, dans la cellule hôte, résulte d’un processus actif et orienté. Le tachyzoïte est orienté antérieurement par le conoïde (A) et possède des organites sécrétoires appelés rhoptries. Lorsque le conoïde entre en contact avec une cellule hôte (B), le parasite relargue, dans le cytosol et la vacuole parasitophore en formation, de nombreuses protéines, essentiellement issues des rhoptries qui se vident. Ces protéines participent à la formation de la membrane de la vacuole parasitophore et permettront les interactions avec les différentes fonctions cellulaires. |
 | Figure 4.
Schématisation des fonctions de ROP16. Après pénétration dans la cellule hôte, le tachyzoïte libère dans le cytosol des protéines dont la protéine ROP16. La présence de la protéine ROP16 issue des souches de type I ou III dans le cytosol de la cellule hôte est associée, entre autre, à la phosphorylation des molécules STAT3 ou STAT6. Dans le noyau de la cellule hôte, ces protéines phosphorylées sont des facteurs de transcription pouvant modifier l’expression de cytokines. La protéine ROP16 provenant de souches de type II ne semble pas capable d’induire une telle cascade. |
Les protéines ROP du toxoplasme : un exemple de modulation directe du système immunitaire de l’hôte Dans trois articles publiés récemment et utilisant des approches distinctes, trois équipes, dont celle de John Boothroyd, démontrent le rôle prééminent d’une autre protéine de rhoptrie à activité kinase, ROP18, dont le gène est situé à proximité de celui de ROP16. ROP18, au cours de l’invasion parasitaire, se localise dans la membrane de la vacuole parasitophore. ROP18 est responsable de la différence de virulence entre les souches de classes I, II et II [
7–
9], car cette protéine semble moduler directement la prolifération intracellulaire du parasite [ 9] grâce à son activité kinase. À la différence de ROP16, ROP18 ne subvertit pas la signalisation intracellulaire de l’hôte. Le travail de l’équipe de John Boothroyd montre pour la première fois l’interaction moléculaire de protéines d’un parasite avec un système de régulation du système immunitaire de l’hôte. Il corrobore les observations faites récemment par l’équipe d’Eric Denkers qui a réalisé une étude transcriptomique des gènes de macrophages modulés par l’infection d’une souche de type I [
10]. Cette équipe rapporte également que les parasites de type I bloquent la réponse des macrophages à la stimulation par le LPS (lipopolysaccharide). Eric Denkers montre dans des macrophages infectés in vitro que seuls les tachyzoïtes vivants peuvent activer la phosphorylation de STAT3 et qu’ils suppriment l’augmentation de l’IL-12 de façon STAT3 dépendante dans des cellules parasitées et stimulées par du LPS. L’observation qu’il faille un parasite vivant pour obtenir de tels effets est logique si l’on incrimine l’injection de ROP16 dans le cytosol de la cellule parasitée. Bien que l’équipe de John Boothroyd ait suggéré qu’il y ait des facteurs intermédiaires entre ROP16 et STAT3, les travaux d’Eric Denkers excluent la participation de l’IL-10 qui aurait pu constituer l’intermédiaire évoqué. |
En conclusion : jeu complexe entre le parasite et l’hôte Les conclusions de ces travaux sont tirées d’expériences in vitro, ne prenant pas en compte toute la complexité des interactions cellulaires au sein d’un tissu infecté. Il en ressort cependant que le toxoplasme peut, par l’injection de protéines dans le cytosol, moduler directement la réponse immune. La modulation de la réponse immune peut avoir de multiples conséquences directes sur le cycle parasitaire, puisque l’absence de stimulation des réponses immune de type Th1 peut favoriser la multiplication du parasite. Cependant, une réponse immune non contrôlée peut conduire à des phénomènes délétères d’immunopathologie. Le déroulement d’une infection toxoplasmique est également différent selon l’espèce hôte. Les résultats décrits ci-dessus concernent essentiellement des expérimentations menées in vitro, ou chez la souris par des voies d’inoculation non physiologiques. Pour établir une réelle corrélation entre la virulence et l’expression d’un type donné de protéines comme ROP16 ou ROP18 dans un hôte donné, il faudra réaliser des infections in vivo par voie orale suivies de véritables analyses histopathologiques et immunologiques, prenant en compte une voie d’inoculation naturelle et la multiplicité des interactions cellulaires qui peuvent influencer l’issue de la toxoplasmose. |
1. Buzoni-Gatel D, Schulthess J, Menard LC, Kasper LH. Mucosal defences against orally acquired protozoan parasites, emphasis on Toxoplasma gondii infections. Cell Microbiol 2006; 8 : 535–44. 2. Courret N, Darche S, Sonigo P, et al. CD11c- and CD11b-expressing mouse leukocytes transport single Toxoplasma gondii tachyzoites to the brain. Blood 2006; 107 : 309–16. 3. Bohne W, Heesemann J, Gross U. Induction of bradyzoite-specific Toxoplasma gondii antigens in gamma interferon-treated mouse macrophages. Infect Immun 1993; 61 : 1141–5. 4. Saeij JP, Coller S, Boyle JP, et al. Toxoplasma co-opts host gene expression by injection of a polymorphic kinase homologue. Nature 2007; 445 : 324–7. 5. Rutschman R, Lang R, Hesse M, et al. Cutting edge: Stat6-dependent substrate depletion regulates nitric oxide production. J Immunol 2001; 166 : 2173–7. 6. Dubremetz JF. Rhoptries are major players in Toxoplasma gondii invasion and host cell interaction. Cell Microbiol 2007; 9 : 841–8. 7. Taylor S, Barragan A, Su C, et al. A secreted serine-threonine kinase determines virulence in the eukaryotic pathogen Toxoplasma gondii. Science 2006; 314 : 1776–80. 8. Saeij JP, Boyle JP, Coller S, et al. Polymorphic secreted kinases are key virulence factors in toxoplasmosis. Science 2006; 314 : 1780–3. 9. El Hajj H, Lebrun M, Arold S, et al. ROP18 is a rhoptry kinase controlling the intracellular proliferation of Toxoplasma gondii. Plos Pathogen 2007; 3 : e14. 10. Butcher BA, Kim L, Panopoulos AD, et al. IL-10-independent STAT3 activation by Toxoplasma gondii mediates suppression of IL-12 and TNF-alpha in host macrophages. J Immunol 2005; 174 : 3148–52. |





